 (Mulți combustibili moderni pentru rachete sunt amestecuri solide de substanțe combinate în cantități măsurate cu atenție și aprinse pentru a produce o reacție chimică generatoare de forță. (Credit: modificarea lucrării de către NASA))
(Mulți combustibili moderni pentru rachete sunt amestecuri solide de substanțe combinate în cantități măsurate cu atenție și aprinse pentru a produce o reacție chimică generatoare de forță. (Credit: modificarea lucrării de către NASA))
Rachetele cu combustibil solid sunt o caracteristică centrală în programele de explorare spațială din lume, inclusiv noul sistem de lansare spațială dezvoltat de Administrația Națională pentru Aeronautică și Spațiu (NASA) pentru a înlocui flota retrasă a navetei spațiale (Figura de sus). Motoarele acestor rachete se bazează pe amestecuri solide pregătite cu grijă de substanțe chimice combinate în cantități măsurate cu precizie. Aprinderea amestecului inițiază o reacție chimică viguroasă care generează rapid cantități mari de produși gazoși. Aceste gaze sunt evacuate din motorul rachetei prin duza acestuia, oferind forța necesară pentru a propulsa sarcini utile grele în spațiu. Atât natura acestei reacții chimice, cât și relațiile dintre cantitățile de substanțe consumate și produse de reacție sunt considerații de importanță critică care determină succesul tehnologiei. Acest capitol va descrie modul de simbolizare a reacțiilor chimice folosind ecuații chimice, modul de clasificare a unor reacții chimice comune prin identificarea modelelor de reactivitate și modul de determinare a relațiilor cantitative dintre cantitățile de substanțe implicate în reacțiile chimice, adică stoichiometria reacției.
Scrierea și echilibrarea ecuațiilor chimice
Un capitol anterior al acestui text a introdus utilizarea simbolurilor elementelor pentru a reprezenta atomii individuali. Când atomii câștigă sau pierd electroni pentru a produce ioni sau se combină cu alți atomi pentru a forma molecule, simbolurile lor sunt modificate sau combinate pentru a genera formule chimice care reprezintă în mod corespunzător aceste specii. Extinderea acestui simbolism pentru a reprezenta atât identitățile, cât și cantitățile relative de substanțe care suferă o schimbare chimică (sau fizică) implică scrierea și echilibrarea unei ecuații chimice. Luați în considerare ca exemplu reacția dintre o moleculă de metan (CH4) și două molecule de oxigen diatomic (O2) pentru a produce o moleculă de dioxid de carbon (CO2) și două molecule de apă (H2O). Ecuația chimică reprezentând acest proces este prezentată în jumătatea superioară a figurii de mai jos, cu modele moleculare care umplu spațiul prezentate în jumătatea inferioară a figurii.
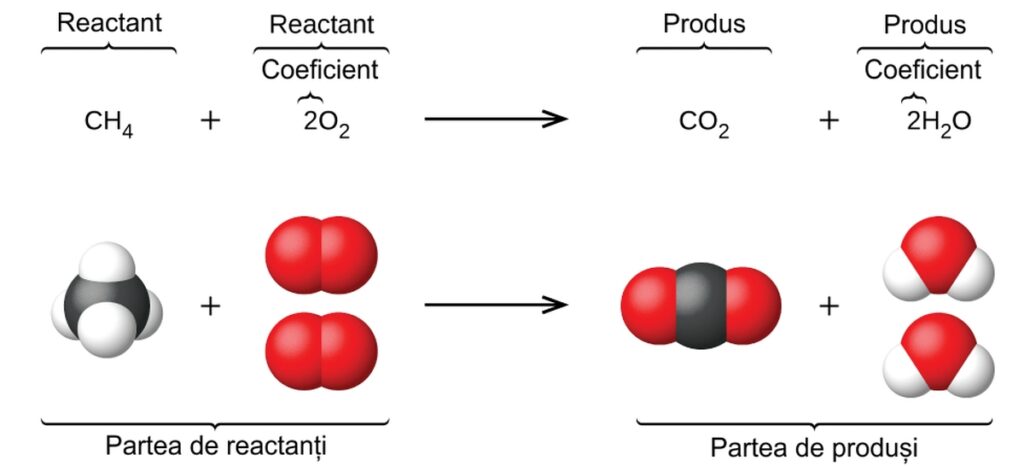 (Reacția dintre metan și oxigen pentru a produce dioxid de carbon și apă (prezentată în partea de jos) poate fi reprezentată printr-o ecuație chimică folosind formule (sus).)
(Reacția dintre metan și oxigen pentru a produce dioxid de carbon și apă (prezentată în partea de jos) poate fi reprezentată printr-o ecuație chimică folosind formule (sus).)
Acest exemplu ilustrează aspectele fundamentale ale oricărei ecuații chimice:
- Substanțele care sunt supuse reacției se numesc reactanți, iar formulele lor sunt plasate în partea stângă a ecuației.
- Substanțele generate de reacție se numesc produse, iar formulele lor sunt plasate în partea dreaptă a ecuației.
- Semnele plus (+) separă formulele individuale ale reactantului și ale produsului, iar o săgeată (→) separă părțile reactant și produs (stânga și dreapta) ale ecuației.
- Numerele relative ale speciilor de reactanți și produse sunt reprezentate prin coeficienți (numerele plasate imediat în stânga fiecărei formule). Un coeficient de 1 este de obicei omis.
Este o practică obișnuită să folosiți cei mai mici coeficienți cu număr întreg posibil într-o ecuație chimică, așa cum se face în acest exemplu. Realizați, totuși, că acești coeficienți reprezintă numărul relativ de reactanți și produși și, prin urmare, ei pot fi interpretați corect ca rapoarte. Metanul și oxigenul reacționează pentru a produce dioxid de carbon și apă într-un raport de 1:2:1:2. Acest raport este satisfăcut dacă numerele acestor molecule sunt, respectiv, 1-2-1-2, sau 2-4-2-4, sau 3-6-3-6 și așa mai departe (Figura de mai jos). De asemenea, acești coeficienți pot fi interpretați cu privire la orice unitate de cantitate (număr) și astfel această ecuație poate fi citită corect în mai multe moduri, inclusiv:
- O moleculă de metan și două molecule de oxigen reacționează pentru a produce o moleculă de dioxid de carbon și două molecule de apă.
- O duzină de molecule de metan și două duzini de molecule de oxigen reacționează pentru a produce o duzină de molecule de dioxid de carbon și două duzini de molecule de apă.
- Un mol de molecule de metan și 2 moli de molecule de oxigen reacționează pentru a produce 1 mol de molecule de dioxid de carbon și 2 moli de molecule de apă.
 (Indiferent de numărul absolut de molecule implicate, raporturile dintre numărul de molecule ale fiecărei specii care reacționează (reactivii) și moleculele fiecărei specii care se formează (produșii) sunt aceleași și sunt date de ecuația reacției chimice.)
(Indiferent de numărul absolut de molecule implicate, raporturile dintre numărul de molecule ale fiecărei specii care reacționează (reactivii) și moleculele fiecărei specii care se formează (produșii) sunt aceleași și sunt date de ecuația reacției chimice.)
Sursa: Chemistry 2e, by OpenStax, access for free at https://openstax.org. ©2020 Rice University, licența CC BY 4.0. Traducere și adaptare: Nicolae Sfetcu, © 2022 MultiMedia Publishing










Lasă un răspuns